斯蒂文斯重排反应
(重定向自Stevens重排反应)
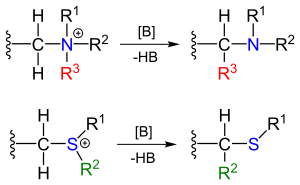
斯蒂文斯重排反应(Stevens rearrangement)指季铵盐和锍鎓盐用碱处理发生1,2-重排,得到相应的胺和硫醚类。
历史 编辑
1928年托马斯·S·斯蒂文斯发现二甲氨基苯乙酮与苄溴的反应产物,在氢氧化钠水溶液处理之下,可重排为α-苄化的叔胺产物。[1]
1932年,斯蒂文斯又发现了含硫底物的类似反应。[2]
反应机理 编辑
季铵盐去质子化后形成的叶立德是反应的关键中间体,此中间体受到R基吸电子性的影响而得到稳定。[3][4]然后,发生一个基团从杂原子上1,2-迁移至碳负,这之中各基团迁移顺序为炔丙基>烯丙基>苄基>烷基,而且迁移基团若带有手性中心则在迁移后通常得到构型保持的产物。
根据伍德沃德-霍夫曼规则,斯蒂文斯重排是四电子德对称性禁阻反应,因此重排应该不是协同步骤。现在一般认为叶立德通过均裂产生被束缚在溶剂笼中很难发生旋转的自由基对,自由基对再发生很快的分子内重组得到产物。
拓展 编辑
2、利用氟离子去硅产生叶立德
3、经由卡宾产生叶立德
参见 编辑
参考资料 编辑
- ^ T.S. Stevens et al. J. Chem. Soc., 1928, 3193
- ^ T.S. Stevens et al. J. Chem. Soc., 1932, 1926
- ^ M B Smith, J March. March's Advanced Organic Chemistry (Wiley, 2001) (ISBN 0-471-58589-0)
- ^ Strategic Applications of Named Reactions in Organic Synthesis Laszlo Kurti, Barbara Czako Academic Press (March 4, 2005) ISBN 0-12-429785-4
- ^ Macrocycle Ring Expansion by Double Stevens RearrangementKeisha K. Ellis-Holder, Brian P. Peppers, Andrei Yu. Kovalevsky, and Steven T. Diver Org. Lett.; 2006; 8(12) pp 2511 - 2514; (Letter) doi:10.1021/ol060657a