鈣調蛋白
鈣調蛋白(英語:Calmodulin,簡稱CaM),又稱為攜鈣素,是一種能與鈣離子結合的蛋白質,普遍存在真核生物細胞中。
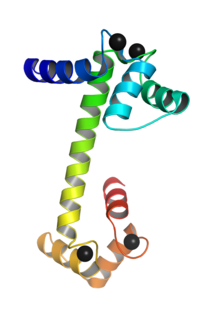
鈣調蛋白是一種多功能中介鈣結合蛋白。[1]它是第二信使的細胞內靶點,鈣調蛋白的激活需要的結合。一旦與結合,鈣調蛋白作為鈣信號轉導通路的一部分,通過改變激酶或磷酸酶等目標蛋白的活性而起到信號轉導的作用。[2][3]
結構 編輯
鈣調蛋白由148個氨基酸組成(分子量為16700Da),其氨基酸序列高度保守;含有大量酸性氨基酸(有1/3是穀氨酸和天冬氨酸),為酸性蛋白質(等電點為4.3)。[4]鈣調蛋白中含有兩個幾乎對稱的啞鈴型結構域,中間由一個柔性連接區域連接,每一個結構域都有一對EF手模體,總共含有4個EF手模體,每一個EF手結構模體都有一個鈣離子結合位點。鈣調蛋白通過四個鈣離子結合位點與 結合的水平來感知細胞內的 水平。
鈣離子結合區在氨基酸序列中的位置是:21 - 32、57 - 68、94 - 105和130 -141(從N端到C端);鈣結合的每個區域都有12個氨基酸殘基的長度。這些區域位於兩個α-螺旋結構之間,前兩個區域(21 - 32和57 - 68)位於鏈接區域的一邊。[5]
鈣調蛋白的結構特點 編輯
鈣調蛋白的靶蛋白種類繁多,這要求鈣調蛋白的結構具有一定的特點。其特點可以概括為如下兩方面:
一、鈣調蛋白的結構具有高度可變性(Flexibility)。通過比對自由狀態下的鈣調蛋白的結構與結合到靶蛋白上的鈣調蛋白的結構,可以很容易發現鈣調蛋白結構的可變性。但核磁共振技術的研究表明即使在自由狀態下,鈣調蛋白的柔性連接區域也表現出動態構象。簡而言之,鈣調蛋白的連接區域是天然無摺疊蛋白片段(Intrinsic Disordered Proteins)。
二、鈣調蛋白非極性結合位點的口袋形狀具有通用性,它不需要靶蛋白具有特定的氨基酸序列。[5]
一個例子是鈣調蛋白既能與鉀離子通道蛋白結合,又能與N-甲基-D-天冬氨酸受體蛋白(NMDA受體)結合。它們的氨基酸序列相差較大,僅長度就相差50個氨基酸殘基。[6][7]
機制 編輯
EF手結構域為 結合提供了一個電負性環境。鈣結合後,α-螺旋處於垂直的位置,使得鈣調蛋白處在一個開放的構象中,其中甲硫氨酸殘基的疏水性甲基通過構象變化暴露在鈣調蛋白表面,讓鈣調蛋白表面更具有疏水性質。此後鈣調蛋白可以與目標蛋白上的鹼性的兩親性螺旋(BAA螺旋)結合。這些螺旋含有互補的疏水區域。鈣調蛋白的柔性連接區域允許鈣調蛋白的兩個亞基緊密環繞它的靶蛋白。[5]這種特性使它能夠緊密地結合在不同的目標蛋白上。
分子動態學特徵 編輯
C-末端結構域(CTD)在溶液中的結構與x射線解析得到的晶體結構相似,而N-末端結構域(NTD)相對於晶體狀態,其EF手模體的開放程度大大降低。這表明 結合導致N-末端結構域的構象變化大於C-末端結構域。鈣調蛋白的骨架可變性是它擁有廣泛靶蛋白的關鍵。前面已經提及鈣調蛋白中兩個包含EF手模體的球形蛋白質域通過天然無摺疊柔性連結域進行連接,從而能夠實現長程別構效應。
信號轉導的途徑 編輯
鈣調蛋白本身是 作為細胞的第二信使發揮功能的一個中介。它的作用機制可以從兩個方面進行敘述:
細胞質鈣離子水平監測 編輯
細胞質中的鈣離子濃度低至 ,這要求鈣調蛋白對鈣離子濃度的變化非常敏感。鈣調蛋白有4個鈣離子結合位點,相互之間有協同效應,作用關係可以用希爾方程(Hill Equation)進行描述。藉由協同效應,鈣調蛋白能夠對微量鈣離子濃度的變化進行快速響應。鈣調蛋白只有在與鈣離子結合之後才能夠處於開放狀態,具有生物活性,因此鈣調蛋白的活性可以看成細胞質鈣離子水平的一個標度。
對下游蛋白的活性進行調節 編輯
鈣調蛋白主要通過調節靶酶活性的方式調節細胞的代謝過程。CaM-Ca2+複合體是一些酶(主要是激酶和磷酸酶)的輔酶,對於它們發揮功能是必要的。有研究表明CaM-Ca2+還可以與鉀離子通道蛋白、一些細胞膜上的受體相互作用[6][7]。
功能 編輯
(文獻來源請求)
鈣調蛋白可以與很多不同的蛋白質結合,因此影響了細胞功能的方方面面。鈣調素參與介導的生命活動進程有炎症反應、代謝、細胞凋亡、肌肉收縮、細胞內運動、短期和長期記憶、神經生長以及免疫反應等。一些研究者還發現,鈣調素可以在細胞核內發揮功能,其可能參與前mRNA的剪切和調控核糖體聚合及功能發揮。[8]許多鈣調素結合蛋白其本身不能結合鈣離子,而鈣離子在細胞的信號傳導體系中作為重要的第二信使,所以這些鈣調素結合蛋白就可以利用鈣調素來作為鈣感應器和信號傳導分子。[9]鈣調素可以調節細胞內鈣離子的濃度;而在內質網中,鈣調素還可以被用作鈣儲存介質。鈣調素在結合鈣離子前後會發生構象變化,因此可以在特定的反應中結合特定的蛋白質。鈣調素的功能可以被轉錄以及翻譯後修飾(如磷酸化、乙酰化、甲酰化和蛋白酶解)所調控。[10]
參見 編輯
參考文獻 編輯
- ^ Stevens, F. C. Calmodulin: an introduction. Canadian Journal of Biochemistry and Cell Biology = Revue Canadienne De Biochimie Et Biologie Cellulaire. August 1983, 61 (8): 906–910 [2017-11-18]. ISSN 0714-7511. PMID 6313166. (原始內容存檔於2017-12-01).
- ^ Chin, D.; Means, A. R. Calmodulin: a prototypical calcium sensor. Trends in Cell Biology. August 2000, 10 (8): 322–328 [2017-11-18]. ISSN 0962-8924. PMID 10884684. (原始內容存檔於2017-12-08).
- ^ Dale., Purves,. Neuroscience. 5th ed. Sunderland, Mass.: Sinauer Associates https://web.archive.org/web/20190701170043/https://www.worldcat.org/title/neuroscience/oclc/754389847. 2012 [2017-11-18]. ISBN 9780878936953. OCLC 754389847. (原始內容存檔於2019-07-01). 缺少或
|title=為空 (幫助) - ^ 《中國大百科全書》光盤版:生物學,鈣調素
- ^ 5.0 5.1 5.2 Goodsell, D.S. Calmodulin. RCSB Protein Data Bank. [2017-11-18]. doi:10.2210/rcsb_pdb/mom_2003_8. (原始內容存檔於2021-04-13).
- ^ 6.0 6.1 Ataman, Z.A.; Gakhar, L. ; Sorensen, B.R.; Hell, J.W., Shea, M.A. Crystal Structure of Ca2+/Calmodulin bound to NMDA Receptor NR1C1 peptide. 2007-11-13 [2017-11-18]. (原始內容存檔於2017-12-01).
- ^ 7.0 7.1 Zhang, M., Pascal, J.M., Logothetis, D.E., Zhang, J.F. Calcium-calmodulin (T79D) complexed with the calmodulin binding domain from a small conductance potassium channel SK2-a. 2014-08-06 [2017-11-18]. (原始內容存檔於2016-03-15).
- ^ (英文)Agell, N.; et al. New nuclear functions for calmodulin. Cell Calcium. 1998, 23 (2-3): 115–121. PMID 9601606.
- ^ (英文)Chin, D. and Means, A. R. Calmodulin: a prototypical calcium sensor. Trends Cell Biol. 2000, 10 (8): 322–328. PMID 10884684.
- ^ (英文)Kortvely, E. and Gulya, K. Calmodulin, and various ways to regulate its activity. Life Sci. 2004, 74 (9): 1065–1070. PMID 14687647.
