氯化鐠
化合物
氯化鐠(III)是一種無機化合物,化學式為PrCl3。它是藍綠色的固體,在潮濕空氣中迅速吸水,轉變為亮綠色的七水合物。
| 氯化鐠 | |||
|---|---|---|---|

| |||
| |||
| IUPAC名 氯化鐠 Praseodymium(III) chloride | |||
| 別名 | 三氯化鐠 | ||
| 識別 | |||
| CAS號 | 10361-79-2 ? | ||
| PubChem | 66317 | ||
| SMILES |
| ||
| InChI |
| ||
| 性質 | |||
| 化學式 | PrCl3 | ||
| 莫耳質量 | 247.24 g/mol(無水) 373.77 g/mol(七水) g·mol⁻¹ | ||
| 外觀 | 藍綠色固體(無水) 亮綠色固體(七水) | ||
| 密度 | 4.02 g/cm3(無水) 2.250 g/cm3(七水) | ||
| 熔點 | 786 °C | ||
| 沸點 | 1905 °C[1] | ||
| 溶解性(水) | 104.0 g/100 ml (13°C) | ||
| 結構 | |||
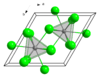
| 晶體結構 | 六方[1],hP8 | ||
| 空間群 | P63/m, No. 176 | ||
| 配位幾何 | Tricapped trigonal prismatic (nine-coordinate) | ||
| 危險性 | |||
| 歐盟編號 | 未列出 | ||
| 主要危害 | 有刺激性 | ||
| 相關物質 | |||
| 其他陰離子 | 三氟化鐠 溴化鐠 碘化鐠 硝酸鐠 | ||
| 其他陽離子 | 氯化鈰 氯化釹 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
製備
編輯- 2 Pr + 6 HCl → 2 PrCl3 + 3 H2
它通常通過真空升華法提純[4]
氯化鐠的水合物可以由金屬鐠或碳酸鐠(III)與鹽酸溶液反應得到:
- Pr2(CO3)3 + 6 HCl + 15 H2O → 2 [Pr(H2O)9]Cl3 + 3 CO2
無水氯化鐠可以利用氯化銨在400℃對其水合物作用來脫水,[4][5]也可以用氯化亞碸來脫水[4][6][1]:
- PrCl3·6H2O + 6 SOCl2 → PrCl3 + 6 SO2↑ + 12 HCl↑
- 4 Pr2O3 + 3 S2Cl2 + 9 Cl2 → 8 PrCl3 + 6 SO2 (400~700℃反應)
- 4 Pr2O3 + 12 S2Cl2 → 8 PrCl3 + 2 SO2 + 18 S (250~500℃反應)
- Pr2O3 + 3 SOCl2 → 2 PrCl3 + 3 SO2 (450℃反應)
- Pr2O3 + 3 CCl4 → 2 PrCl3 + 3 Cl2 + 3 CO (400~500℃反應)
- Pr2O3 + 6 NH4Cl → 2 PrCl3 + 3 H2O + 6 NH3 (加熱反應)
化學反應
編輯氯化鐠是一種路易斯酸,根據HSAB理論歸類為「硬」。對水合氯化鐠的迅速加熱會產生少量的水解,產生PrOCl。[4][7]
無水氯化鐠很容易吸水並潮解[7],也能吸收氨,生成氨合物(PrCl3·nNH3)。[1]
氯化鐠和氯化鉀反應,可以形成一個穩定的路易斯酸鹼絡合物K2PrCl5,這種化合物展現出有趣的光學和磁的性質.[2]
氯化鐠的水溶液可以製備難溶的鐠化合物。例如,磷酸鐠(III)和氟化鐠(III)可以通過相應的複分解反應製備:
- PrCl3 + K3PO4 → PrPO4 + 3 KCl
- PrCl3 + 3 NaF → PrF3 + 3 NaCl
當和鹼金屬氯化物加熱時,會形成一系列的三元化合物,它們的化學式為MPr2Cl7, M3PrCl6、 M2PrCl5和M3Pr2Cl9。(其中M = K, Rb, Cs)[8]
參考資料
編輯- ^ 1.0 1.1 1.2 1.3 1.4 《無機化學叢書》.第七卷 鈧 稀土元素.易憲武 等. 科學出版社. ISBN 978-7-03-030574-9. 1.3.3 氧化態+3的化合物. P160. 2. 鹵素化合物
- ^ 2.0 2.1 J. Cybinska, J. Sokolnicki, J. Legendziewicz, G. Meyer, Journal of Alloys and Compounds, 341, 115–123 (2002).
- ^ L. F. Druding, J. D. Corbett, "Lower Oxidation States of the Lanthanides. Neodymium(II) Chloride and Iodide", J. Am. Chem. Soc. 83, 2462 (1961); J. D. Corbett, Rev. Chim. Minerale 10, 239 (1973),
- ^ 4.0 4.1 4.2 4.3 F. T. Edelmann, P. Poremba, in: Synthetic Methods of Organometallic and Inorganic Chemistry, (W. A. Herrmann, ed.), Vol. 6, Georg Thieme Verlag, Stuttgart, 1997.
- ^ M. D. Taylor, P. C. Carter, "Preparation of anhydrous lanthanide halides, especially iodides", J. Inorg. Nucl. Chem., 24, 387 (1962); J. Kutscher, A. Schneider, Inorg. Nucl. Chem. Lett., 7, 815 (1971).
- ^ J. H. Freeman, M. L. Smith, "The preparation of anhydrous inorganic chlorides by dehydration with thionyl chlorid", J. Inorg. Nucl. Chem., 7, 224 (1958).
- ^ 7.0 7.1 Rare Earth Coordination Chemistry: Fundamentals and Applications. Chun-Hui Huang. John Wiley & Sons (Asia) Pte. Ltd. 2 Clementi Loop, #02-01, Singapore 129809. p26. 1.5.2 Rare Earth Halide and Perchlorate Compounds
- ^ Gerd Meyer, "Ternary Chlorides and Bromides of the Rare-Earth Elements", Inorganic Syntheses, 1990, Volume 30, pp. 72–81. doi:10.1002/9780470132616.ch15
補充閱讀
編輯- CRC Handbook of Chemistry and Physics (58th edition), CRC Press, West Palm Beach, Florida, 1977.
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, 1984.
- S. Sugiyama, T. Miyamoto, H. Hayashi, M. Tanaka, J. B. Moffat Journal of Molecular Catalysis A, 118, 129-136 (1997).
- Druding L. F., Corbett J. D., Ramsey B. N. Rare Earth Metal-Metal Halide Systems. VI. Praseodymium Chloride. Inorganic Chemistry. 1963, 2 (4): 869–871. doi:10.1021/ic50008a055.