六硼化钙
六硼化钙(又称硼化钙),是钙和硼的化合物,化学式为CaB6。具有优良导电性、高硬度、化学稳定性和高熔点,是重要的材料。是一种黑色、有光泽、不活泼的粉末,密度小。具有典型的金属硼化物的立方结构,由6个硼原子的八面体单元与钙原子结合。[2] CaB6和掺杂镧的CaB6都表现出弱铁磁性,这是一个值得注意的事实,因为钙和硼既不是磁性的,也不具有内部3d或4f电子壳层,这通常是铁磁性所必需的。
| 六硼化钙 | |
|---|---|
| |
| IUPAC名 Calcium hexaboride | |
| 别名 | 硼化钙 |
| 识别 | |
| CAS号 | 12007-99-7 |
| PubChem | 16212529 |
| ChemSpider | 24765176 |
| SMILES |
|
| InChI |
|
| EINECS | 234-525-3 |
| 性质 | |
| 化学式 | CaB6 |
| 摩尔质量 | 104.94 g·mol⁻¹ |
| 外观 | 黑色粉末 |
| 密度 | 2.45 g/cm3 |
| 熔点 | 2235 °C(2508 K) |
| 溶解性(水) | 不可溶 |
| 结构 | |
| 晶体结构 | 立方晶系 |
| 空间群 | Pm3m ; Oh[1] |
| 相关物质 | |
| 相关化学品 | 四硼化钙 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
属性
编辑CaB6曾由于具有各种特殊的物理性质,例如超导性、价态波动和近藤效应而被研究。[3] 然而,CaB6最显着的特性是其铁磁性。 它意外出现在高温(600 K)和低磁矩(低于0.07 每个原子)下。这种高温铁磁性的来源是稀释电子气的铁磁相与硼化钙中假定的激子态或样品表面上的外部杂质的连接。杂质可能包括铁和镍 ,可能来自用于制备样品的硼中。[4]
CaB6不溶于水、甲醇和乙醇,并且在酸中缓慢溶解。[5] 显微硬度是27GPa, 努氏硬度为2600kg / mm2 ,杨氏模量为379 GPa,纯晶体电阻率大于2·10 10Ω·m。 [6] [7] CaB6是能隙约为1.0电子伏特的半导体。许多CaB6样品的低、半金属电导率可以解释为由于杂质和可能的非化学计量目的的无意掺杂导致。[8]
结构信息
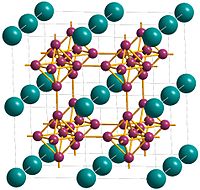
编辑六硼化钙的晶体结构是立方晶格,晶胞中心是钙,顶点是通过硼硼键连接的紧密规则的硼原子八面体形成的三维硼网络。[5]每个钙都有24个最近邻的硼原子。[1]钙原子以简单的立方体堆积排列,因此在位于立方体顶点的八个钙原子之间存在空穴。[9] 通过引入八面体B6基团来扩展简单的立方结构,该结构由钙和六硼化物基团填充,类似于CsCl。[9] 描述六硼化钙的另一种方式是具有金属B6 2-八面体聚合阴离子的CsCl型结构,钙原子占据Cs位点,B6八面体在Cl位点。 [10] Ca-B键长为3.05Å,BB键长度为1.7Å。[9]
43Ca的核磁共振NMR数据包含-56.0 ppm的δ峰和在-41.3 ppm的δ异,其中δ异最大峰宽度取为0.85,负偏移是由于高配位数。 [10]
拉曼数据:由于活动模式分别为A1g,Eg和T2g,硼化钙在754.3、1121.8和1246.9cm-1处有三个拉曼峰。 [1]
观察到的振动频率cm-1:1270(强)来自A1g伸展,1154(中位)和1125(肩部)来自Eg伸展,526、520、485和470来自F1g旋转,775(强)和762(肩部)来自F2g弯曲,1125(强)和1095(弱)来自F1u弯曲,330和250来自F1u平移,以及880(中间)和779来自F2u弯曲。 [1]
制备
编辑- 工业生产的主要反应之一是: [6]
- CaO + 3 B2O3 + 10 Mg → CaB6 + 10 MgO
其他生产CaB6粉末的方法包括:
- 钙或氧化钙和硼在1000℃下直接反应;
- Ca + 6B→CaB6
- Ca(OH) 2 + 7B→CaB6 + BO(g) + H2O(g)
- CaCl2 + 6NaBH4 →CaB6 + 2NaCl + 12H2 + 4Na
生产出的材料质量相对较差。 [12]
用途
编辑硼化钙用于制造硼合金钢[5]和作为脱氧试剂无氧铜的生产。后者由于硼在铜中的低溶解度导致比常规磷脱氧铜更高的导电性。[6]CaB6还可用作高温材料、表面保护、磨料、工具和耐磨材料。
CaB6导电性优良,功函数低,因此可用作热阴极材料。在高温下使用时,硼化钙会被氧化,导致其性能降低并缩短其使用寿命。[13]
CaB6也是n型热电材料的有希望的候选者,因为其功率因数不小于普通热电材料Bi2Te3和PbTe的功率因数。 [7]
CaB6也可用作碳粘结耐火材料中的抗氧化剂。
注意事项
编辑硼化钙对眼睛、皮肤和呼吸系统有刺激性。本产品处理时应使用适当的防护眼镜和防护服。切勿将硼化钙倒入排水管或向其中加水。
参见
编辑参考文献
编辑- ^ 1.0 1.1 1.2 1.3 Yahia, S.; Turrell, S.; Turrell, G.; Mercurio, J. P. Infrared and Raman spectra of hexaborides: force-field calculations, and isotopic effects. J. Mol. Struct. 1990, 224 (1-2): 303–312. Bibcode:1990JMoSt.224..303Y. doi:10.1016/0022-2860(90)87025-S.
- ^ Matkovich, V. I. Boron and Refractory Borides. Berlin: Springer-Verlag. 1977. ISBN 0-387-08181-X.
- ^ J. Etourneau; P. Hagenmuller. Structure and physical features of the rare-earth borides. Philos. Mag. B. 1985, 52 (3): 589. Bibcode:1985PMagB..52..589E. doi:10.1080/13642818508240625..
- ^ Young, D. P; et al. High-temperature weak ferromagnetism in a low-density free-electron gas. Nature. 1999, 397 (6718): 412–414. Bibcode:1999Natur.397..412Y. doi:10.1038/17081.
- ^ 5.0 5.1 5.2 5.3 Calcium boride – Dictionary of Inorganic Compounds. University Press 1 (Cambridge). 1992.
- ^ 6.0 6.1 6.2 Encyclopedia of Inorganic Chemistry 1. West Sussex, England: John Wiley & Sons. 1994.
- ^ 7.0 7.1 7.2 Terry T. Xu; Jian-Guo Zheng; Alan W. Nicholls; Sasha Stankovich; Richard D. Piner; Rodney S. Ruoff. Single-Crystal Calcium Hexaboride Nanowires: Synthesis and Characterization. Nano Lett. 2004, 4 (10): 2051–2055. Bibcode:2004NanoL...4.2051X. doi:10.1021/nl0486620.
- ^ S. Souma; et al. Electronic Band Structure and Fermi Surface of CaB6 Studied by Angle-Resolved Photoemission Spectroscopy. Phys. Rev. Lett. 2003, 90 (2): 027202. Bibcode:2003PhRvL..90b7202S. PMID 12570575. doi:10.1103/PhysRevLett.90.027202.
- ^ 9.0 9.1 9.2 Wells, A. F. Structural Inorganic Chemistry. Oxford: Clarendon Press. 1984: 1055–1056. ISBN 0-19-855125-8.
- ^ 10.0 10.1 Zhongijie, L.; Smith, M. E.; Sowrey, F. E.; Newport, R. J. Probing the local structural environment of calcium by natural-abundance solid-state 43Ca NMR. Physical Review B. 2004, 69 (22): 224107. Bibcode:2004PhRvB..69v4107L. doi:10.1103/PhysRevB.69.224107.
- ^ 11.0 11.1 S. Otani. Preparation of CaB6 crystals by the floating zone method. Journal of Crystal Growth. 1998, 192 (1–2): 346–349. Bibcode:1998JCrGr.192..346O. doi:10.1016/S0022-0248(98)00444-8.
- ^ Shi, L.; et al. Low Temperature Synthesis and Characterization of Cubic CaB6 Ultrafine Powders. Chem. Lett. 2003, 32 (10): 958. doi:10.1246/cl.2003.958.
- ^ Zhigang R. Li; Hong Meng. Organic light-emitting materials and devices. CRC Press. 2006: 516. ISBN 1-57444-574-X.
拓展阅读
编辑- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.