环形细菌染色体
环形细菌染色体是指呈环形DNA分子的细菌染色体。和大多数真核生物的线性DNA不同,典型的细菌染色体是环形的。
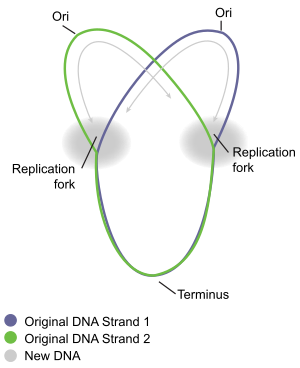
大多数细菌的染色体组由环形的DNA分子构成,这种DNA是没有自由端的。自由端将会给DNA的复制及其稳定性带来巨大困难。含有带DNA端或端粒(大多数真核生物)的染色体的细胞,进化演变出了复杂的机制来克服这些困难。 然而,环形的染色体也给细胞带来了其他的挑战。复制后,两个子代环形染色体有时可能会依然相互连接着或纠缠在一起,必须解决这些问题才能使得在细胞分裂时两个子代细胞均能获得完整的染色体副本。
环形细菌染色体的复制
编辑要理解原核生物DNA复制的过程,最好是借助已被充分研究的大肠埃希氏菌和枯草芽孢杆菌。染色体复制过程由三个主要阶段组成:初始阶段、延伸阶段和终止阶段。染色体起始位置称为复制起点(oriC),在此处有序地合成“启动器”蛋白是初始阶段的开始。该蛋白的合成过程经过调控,确保在每个细胞周期只会发生一次染色体复制。初始阶段中复制起点会合成一种酶,在延伸阶段时,两条臂上的酶朝着相反的方向复制DNA,最终生成两条一模一样的染色体。这一过程被称为双向复制。每根染色体臂上参与DNA复制过程的整个分子结构叫做“复制体”。在复制体最前端的是解旋酶,它解开两条螺旋在一起的DNA链,形成一个移动的“复制叉”。两条被解开的DNA单链用作DNA聚合酶的复制模板。每条DNA单链上聚合酶与解旋酶(连同其他的蛋白质)一起移动,合成一条DNA副本补链。如此进展下去,产生了两条与原DNA链一模一样的副本链。最终,两个复制叉沿着环形染色体再次相遇,相遇的位置大致与复制起点相对,称为终止位置。随后延伸酶分解。在细胞分裂完成之前,形成两个子代染色体。
初始阶段
编辑大肠杆菌的复制起点包含能够被DnaA蛋白质识别的核酸序列,不同种类的细菌都会将自身的该序列严密保护起来。复制起点的DnaA蛋白在调控之下召集其他酶和蛋白质,形成两个完整的复制体来进行双向复制。[1]
复制起点内的DNA序列信息对其功能十分重要。其中包括DnaA箱,它是一段重复的9碱基序列:5'-TTATCCACA-3'[2],可被DnaA蛋白识别。 DnaA蛋白在染色体DNA复制中发挥着重要作用。[3] 结合ATP,在类组织蛋白[HU]的协助下,DnaA蛋白在复制起点的左侧解开一个富三腺苷区域,它将会携带13段结构基元[4],并将打开这两股DNA链以便其他复制蛋白进去该区域。[5]
该区域包含四个“GATC”序列,能够被DNA腺甲基化酶 (DAM)识别。还包含一种能够在序列未甲基化或者半甲基化的时候修改腺嘌呤的酶。腺嘌呤的甲基化十分重要,因为它将改变DNA的构造以促进DNA链的分离[6]。复制起点的这一区域,有解旋的自然倾向。[7]
接下来DnaA蛋白会从DnaB-DnaC综合体中召集解旋酶,既DnaB,到被解旋的区域来形成预启动综合体[8]。在DnaB移位到每个复制叉顶部后,解旋酶解开两条DNA父链,立刻和引发酶发生反应。[9]
为了DNA复制的顺利进行,需要单链的绑定蛋白质来防止DNA单链形成次生结构及二次复性。此外,需要DNA旋转酶来释放由DnaB解旋酶作用造成的拓扑结构上的作用力。
延伸阶段
编辑当复制叉沿着染色体环移动时,形成了一个形似希腊字母西塔Ө的结构。英国生化学家约翰·凯恩斯通过一种创新的方式将DNA复制可视化,在1963年提出了大肠杆菌染色体复制过程中的西塔结构。在他的实验中,他使用含有3H-胸腺的培养液来培养培养基以对染色体进行放射性标记。被标记的核苷基团均匀地混入到细菌染色体中。接下来他小心地将细胞溶解并放到电子显微镜(EM)网格下,通过两个月的X射线照射来分离出染色体。这一实验清晰地阐释了环形细菌染色体的西塔复制模型。[10]
如上所述,细菌染色体的复制以双向的方式进行。通过对复制中的细菌染色体进行放射性同位素标记,第一次展示了这种复制方式。后来试验中正在进行复制的DNA区域通过放射能图像技术被可视化,洗出的胶片可在显微镜下进行细致地观察。这使得研究人员能够看到复制发生的位置。关于双向复制的首次结论性观察来自于对枯草芽孢杆菌研究[11]。不久之后,观察发现大肠杆菌染色体也是双向复制的。[12]
- 参见D.M.Prescott和P.L.Kuempel的1972年论文中的图4:细胞中经19分钟[3H]胸腺嘧啶标记,及2.5分钟[3H]胸腺嘧啶标记和[H]胸苷标记后的大肠杆菌染色体所产生的纹理轨迹。
大肠杆菌的DNA聚合酶III全酶是一种900 kD综合体,本质上呈聚合结构。每个单体包含一个催化核、一个二聚作用的亚单元和一个具有持续合成能力的亚单元。[13] DNA聚合酶III利用自身的一个核心亚单元,来不断地合成前导链,而另一套核心亚单元在环形的后随链上从一个冈崎片段移动到下一个冈崎片段。前导链的合成开始于一小段RNA引物的合成,发生在复制起点,由引发酶(DnaG蛋白质)催化进行。
随后在DNA聚合酶III聚合体和DnaB解旋酶的联合作用下,脱氧核苷酸被添加到这段引物上。之后连续地进行前导链的合成,此时在复制叉处的DNA处于解旋状态。与此不同的是,后随链的合成通过一个个的冈崎片段完成。首先,引发酶合成一段RNA引物;随后,与前导链的合成类似,由DNA聚合酶III与RNA引物结合并向后随链添加脱氧核糖核苷酸。
当一个冈崎片段合成完毕时,复制停止。DNA聚合酶III的核心亚单元与β滑动夹分离[β滑动夹是DNA聚合酶III的具有持续合成能力的亚单元][14]。在DNA聚合酶I[它还对外切酶的活动进行校对]的作用下,RNA引物被移除,由DNA片段取而代之。随后,DNA连接酶将缺口封住,并将这些片段连接起来形成后随链。
终止阶段
编辑DNA复制终止是指复制叉融合及复制体解体,以产出两个独立且完整的DNA分子的过程。它发生在复制终点区域,在染色体上的位置大致与复制起点相对(图5)。终点区域包含多个DNA复制终结站,称为Ter站。需有一个特殊的“复制终结者”蛋白绑定在Ter站才能是复制过程停下来。每个Ter站都有活动极性,也即是说,它将使从某一个方向靠近Ter站的复制叉停止,而从另一个方向靠近过来的复制叉活动不受影响。多个Ter站排列形成两个相对的小组,以使两个方向来的复制叉在他们相遇的这一区域内停下来。这种排列被称为“复制叉陷阱”。[15]
- 参见大肠杆菌复制Ter站的位置和顺序:(A)复制起点和10个复制Ter站位置的图示。(B)复制重点的一致顺序。
在大肠杆菌中,Ter站专门与复制终结者蛋白Tus发生反应。[16] Tus-Ter综合体依照方向性,阻止DnaB解旋酶的DNA解旋作用。[17]
DNA的复制将相对的复制叉分离,使完整的染色体结合成为“索烃”或拓扑结构上的相互关联的环形。这些环形并不是共价相连,但却不能分开,因为它们内旋在一起,并且每个环形都是共价闭合的。这些成链的环形需要拓扑异构酶的作用来将之分离[称为解链作用, decatenation]。在大肠杆菌中,DNA Topo IV酶在成链染色体的分离中有着重要作用,它将一条染色体的两条DNA链暂时性的打断,并允许其他染色体从断裂处通过。
目前,DNA旋转酶在解链作用中的作用还不太明确。从定义上来讲,有两类拓扑异构酶:第一类产生短暂的DNA单链断裂;第二类产生短暂的DNA双链断裂。因此,第一类拓扑异构酶一次解开一个DNA超螺旋,而第二类酶一次解开两个超螺旋。原核生物和真核生物中的Topo I酶都是第一类拓扑异构酶。真核生物中的Topo II酶、细菌的旋转酶和细菌的Topo IV酶都属于第二类拓扑异构酶。
需要记住的是DNA旋转酶事实上进行的是第二类拓扑异构酶作用。因此,它和Topo IV酶(也进行的是第二类拓扑异构酶作用)本质上是同种物质,我们认为这两种蛋白质的功能是相似的。DNA旋转酶的根本作用是对DNA链施以反向超螺旋力,从而使DNA复制时的正向超螺旋松弛。Topo IV酶也能使正向超螺旋松弛,因此,DNA旋转酶和Topo IV酶的作用几乎一样:在DNA聚合酶运作之前,使正向超螺旋松弛,以便DNA复制过程不受拓扑结构扭力阻碍。[18]
某些科学文献中说DNA旋转酶是唯一负责解链作用的酶,引起了争议。 在1997年,一个由Zechiedrich、Khodursky和Cozzarelli主导的实验发现,Topo IV酶是细菌DNA复制中间过程中唯一一种发挥作用的解链酶。[19]在这项实验中,当仅抑制DNA旋转酶时,大多数索烃照常被解链。然而当仅抑制Topo IV酶时,解链作用几乎完全无法进行。该实验结果表明,Topo IV是活体实验中主要的解链酶。虽然DNA旋转酶也在解链作用中发挥一定的作用,它在互联的染色体解链过程中的功能并没有Topo IV重要。
鸣谢
编辑本词条基于2007年CC by SA许可条件下墨尔本大学微生物与免疫学学院的一门课程中Imalda Devaparanam和David Tribe撰写的文章。
参见
编辑参考文献
编辑本文使用的材料取自Citizendium文章《环形细菌染色体复制》,由Creative Commons Attribution-ShareAlike 3.0 Unported License授权许可,而非GFDL
- ^ Jon M. Kaguni DnaA: Controlling the Initiation of Bacterial DNA Replication and More.
- ^ C Weigel, A Schmidt, B Rückert, R Lurz, and W Messer.
- ^ Hirota Y, Mordoh J and Jacob F (1970) On the process of cellular division in Escherichia coli III.
- ^ Bramhill D, Kornberg A. 1988.
- ^ Sekimizu K, Bramhill D and Kornberg A (1987) ATP activates dnaA protein in initiating replication of plasmids bearing the origin of the E.coli chromosome.
- ^ Gotoh O, Tagashira Y. 1981.
- ^ Kowalski D, Eddy MJ. 1989.
- ^ Carr KM, Kaguni JM. 2001.
- ^ Tougu K, Marians KJ. 1996.
- ^ Cairns, J.P.: Cold Spring Harbor Symposia on Quantitative Biology 28:44, 1963.
- ^ Wake, R.G. 1972.
- ^ Prescott D.M., Kuempel P.L. 1972.
- ^ O'Donnell M. , Jeruzalmi D. , Kuriyan J. Clamp loader structure predicts the architecture of DNA polymerase III holoenzyme and RFC.
- ^ Indiani C, O'Donnell M. Mechanism of the delta wrench in opening the beta sliding clamp.
- ^ Duggin IG, Wake RG, Bell SD, Hill TM. 2008.
- ^ Kamada K, Horiuchi T, Ohsumi K, Shimamoto N, Morikawa K. 1996.
- ^ Kaplan DL, Bastia D. 2009.
- ^ Chris Ullsperger and Nicholas R. Cozzarelli.
- ^ E L Zechiedrich , A B Khodursky , N R Cozzarelli.