夏普萊斯不對稱環氧化反應
夏普萊斯不對稱環氧化反應(英文:Sharpless epoxidation)是一種不對稱選擇的化學反應,可以用來從一級或者二級烯丙醇製備2,3-環氧醇。[1][2] 它是以主要發明人巴里·夏普萊斯和香月勗命名的不對稱環氧化反應。該反應大約在1970年代開始得到系統研究,80年代後日臻成熟。[1][2]
| 夏普萊斯不對稱環氧化反應 | |
|---|---|
| 命名根據 | 巴里·夏普萊斯 |
| 反應類型 | 成環反應 |
| 標識 | |
| 有機化學網站對應網頁 | sharpless-epoxidation |
| RSC序號 | RXNO:0000141 |
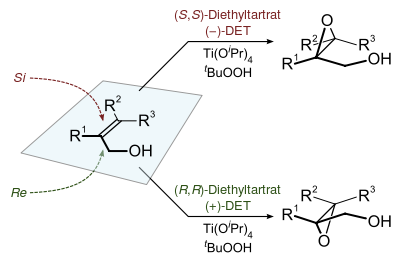
環氧化產物的立體化學是由反應中使用的手性酒石酸酯的非對映體(通常為酒石酸二乙酯或者酒石酸二異丙酯)決定的。氧化試劑為過氧叔丁醇。反應中使用一個催化劑可以形成產物的對映體選擇性,該催化劑通過四異丙氧基鈦和酒石酸二乙酯反應獲得。反應在存在3Å分子篩(3Å MS)的條件下只需5-10 mol%的催化劑量。[3]
夏普萊斯環氧化的成功取決於五大主要原因:首先,環氧化合物能夠簡單的轉化為二醇、氨基醇或者醚,所以在天然產物的全合成當中形成手性的環氧化合物是非常重要的步驟。第二,該反應能夠和許多一級或者二級烯丙醇反應。第三,夏普萊斯環氧化的產物通常具有超過90%的ee值(對映體過量)。第四,通過夏普萊斯環氧化模型可以預測出產物的手性。最後,夏普萊斯環氧化的反應試劑都是商業化的且非常廉價易得。[4]
巴里·夏普萊斯因在不對稱氧化方面的成就分享了2001年度的諾貝爾化學獎。與他共同獲獎的還有:威廉·斯坦迪什·諾爾斯和野依良治。
催化劑結構
編輯催化劑的結構直到現在還未非常確定。還未有研究能夠完全排除其他假定的催化劑。無論如何,所有的研究都表明催化劑是一種[Ti(tartrate)(OR)2] 的二聚體。催化劑模型通過X-射線鑑定了結構。[9]
機理
編輯該反應是以四價鈦酸酯路易斯酸介導,以過氧化氫衍生物為氧化劑(常為叔丁基過氧化氫),以酒石酸乙酯為立體誘導配體而進行的烯烴環氧化反應。
反應選擇性
編輯夏普萊斯環氧化反應的產物可以通過下列的模型進行預測:確定一個雙鍵平面,並在雙鍵平面上畫出一個與之圍繞的矩形。朝着右下角畫出烯丙醇羥基,然後按照分子結構在其他矩形角上畫出其他取代基。在氧化方向上,(-)酒石酸乙酯優先從上方和雙鍵反應,而(+)酒石酸乙酯優先從下方與分子進行反應。這種模型對於大多數的烯烴化合物都有效。而當R1基團較大時選擇性會降低,當R2和R3基團較大時選擇性會提高。[1]
烯丙位的1,2-二醇的環氧化產物無法通過這個模型來預測。[10]
動力學拆分
編輯夏普萊斯環氧化同樣可以把一組消旋的二級醇(2,3-環氧醇)進行動力學拆分。雖然在動力學拆分過程的收率不能高於50%,然而在有些反應中ee值能夠接近100%。[11][12]
合成實例
編輯夏普萊斯環氧化對於大多數的一級或者二級烯丙醇都是有效的。除了上述提到的以外,酒石酸二烷基酯對於雙鍵優先進攻的方向性和雙鍵的取代基是無關的。[1]為了展示夏普萊斯環氧化的應用,夏普萊斯小組合成了許多天然產物中間體:酒黴素、紅黴素、白三烯C-1和(+)-環氧十九烷。[13]
作為在當時為數不多的高不對稱選擇性反應,許多針對2,3-環氧醇的合成都進行了開發和研究。[14]
意義
編輯方便、高效、高選擇性、調控性良好的不對稱合成反應。
參見
編輯參考文獻
編輯- ^ 1.0 1.1 1.2 1.3 Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1980, 102, 5974. (doi:10.1021/ja00538a077)
- ^ 2.0 2.1 Hill, J. G.; Sharpless, K. B.; Exon, C. M.; Regenye, R. Org. Syn., Coll. Vol. 7, p.461 (1990); Vol. 63, p.66 (1985). (Article (頁面存檔備份,存於互聯網檔案館))
- ^ Gao, Y.; Hanson, R. M.; Klunder, J. M.; Ko, S. Y.; Masamune, H.; Sharpless, K. B. J. Am. Chem. Soc. 1987, 109, 5765-5780. (doi:10.1021/ja00253a032)
- ^ 4.0 4.1 Uetikon, C. F. Synthesis (Stuttgart) 1986, 88-116.
- ^ Johnson, R. A.; Sharpless, K. B. Comp. Org. Syn. 1991, 7, 389-436. (Review)
- ^ Hüft, E. Top. Curr. Chem. 1993, 164, 63-77. (Review)
- ^ Katsuki, T.; Martin, V. S. Org. React. 1996, 48, 1-300. (Review)
- ^ Pfenninger, A. Synthesis 1986, 89-116. (Review)
- ^ Finn, M. G.; Sharpless, K. B. J. Am. Chem. Soc. 1991, 113, 113-126. (doi:10.1021/ja00001a019)
- ^ Takano, S.; Iwabuchi, Y.; Ogasawara, K. J. Am. Chem. Soc. 1991, 113, 2786-2787. (doi:10.1021/ja00007a082)
- ^ Kitano, Y.; Matsumoto, T.; Sato, F. Tetrahedron 1988, 44, 4073-4086.
- ^ Martin, V.; Woodard, S.; Katsuki, T.; Yamada, Y.; Ikeda, M.; Sharpless, K. B. J. Am. Chem. Soc. 1981, 103, 6237-6240. (doi:10.1021/ja00410a053)
- ^ Rossiter, B.; Katsuki, T.; Sharpless, K. B. J. Am. Chem. Soc. 1981, 103, 464-465. (doi:10.1021/ja00392a038)
- ^ Sharpless, K. B.; Behrens, C. H.; Katsuki, T.; Lee, A. W. M.; Martin, V. S.; Takatani, M.; Viti, S.M.; Walker, F. J.; Woodard, S. S. Pure Appl. Chem. 1983, 55, 589.