库尔提斯重排反应
柯提斯重排反应(Curtius重排反应)是一个重排反应,首先由西奥多·柯提斯(Theodor Curtius)发现,反应中酰基叠氮重排生成异氰酸酯。
关于此反应的综述参见:。
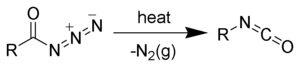
产物可与一系列亲核试剂反应:与水作用水解得到胺;与苯甲醇反应生成带有苄氧羰基保护基(Cbz)的胺类;与叔丁醇作用生成带有叔丁氧羰基保护基(Boc)的胺类,用作有机合成中的重要中间体。

反应机理
编辑反应中,酰基叠氮失去氮气生成酰基乃春(氮烯)2,然后烃基迅速迁移,生成产物异氰酸酯3:
延伸
编辑在Curtius重排反应的基础上,Darapasky递降反应(A. Darapsky, 1936)以α-氰基酯为原料,通过重排反应生成氨基酸。
参考资料
编辑- ^ Curtius, T. Ber. 1890, 23, 3023.
- ^ Curtius, T. J. Prakt. Chem. 1894, 50, 275.
- ^ Smith, P. A. S. Org. React. 1946, 3, 337-449. (Review)
- ^ Scriven, E. F.; Turnbull, K.; Chem. Rev. 1988, 88, 297-368. Review[永久失效链接]
- ^ Kaiser, C.; Weinstock, J. Organic Syntheses, Coll. Vol. 6, p.910 (1988); Vol. 51, p.48 (1971). Article
- ^ Ende, D. J. a.; DeVries, K. M.; Clifford, P. J.; Brenek, S. J. Org. Proc. Res. Dev. 1998, 2, 382-392.
- ^ Lebel, H.; Leogane, O.; Org. Lett. 2005, 7(19), 4107-4110. doi:10.1021/ol051428b
- ^ Shioiri, T.; Yamada, S. Organic Syntheses, Coll. Vol. 7, p.206 (1990); Vol. 62, p.187 (1984). Article
- ^ Shioiri, T.; Ninomiya, K.; Yamada, S. J. Am. Chem. Soc. 1972, 94, 6203-6205. doi:10.1021/ja00772a052
- ^ Ninomiya, K.; Shioiri, T.; Yamada, S. Tetrahedron 1974, 30, 2151-2157.
- ^ Wolff, O.; Waldvogel, S. R. Synthesis 2004, 1303-1305.
- ^ Jessup, P. J.; Petty, C. B.; Roos, J.; Overman, L. E. Organic Syntheses, Coll. Vol. 6, p.95 (1988); Vol. 59, p.1 (1979). Article
- ^ http://www.chempensoftware.com/reactions/RXN051.htm (页面存档备份,存于互联网档案馆)