氯金酸
化合物
氯金酸也稱為四氯合金酸,是分子式為H[AuCl4]的無機化合物。
| 氯金酸 | |
|---|---|
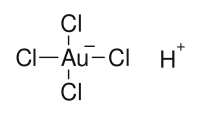
| |

| |
| 別名 | 四氯合金酸 |
| 識別 | |
| CAS號 | 16903-35-8 |
| ChemSpider | 26171 |
| SMILES |
|
| InChI |
|
| InChIKey | IXPWAPCEBHEFOV-ACHCXQQJAP |
| 性質 | |
| 化學式 | HAuCl4 |
| 莫耳質量 | 339.785 g/mol (無水) 393.833 g/mol (三水) 411.85 g/mol (四水) g·mol⁻¹ |
| 外觀 | 金黃色晶體 潮解 |
| 密度 | 3.9 g/cm3 (四水) |
| 熔點 | 254°C |
| 溶解性(水) | 可溶 |
| 溶解性 | 可溶於乙醇、乙醚 |
| 危險性 | |
| 歐盟危險性符號 [1] | |
| 警示術語 | R:R22, R36, R37, R38[1] |
| MSDS | JT Baker |
| 歐盟分類 | 未列出 |
| NFPA 704 | |
| 相關物質 | |
| 其他陰離子 | 溴金酸 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
製備及結構 編輯
- Au + HNO3 + 4 HCl → H[AuCl4] + NO↑ + 2 H2O
加熱時,氯金酸會分解為氯化氫及三氯化金,此反應是可逆反應,因此將三氯化金溶解在鹽酸中也可產生氯金酸。
- AuCl3 + HCl⇌H[AuCl4]
化學性質 編輯
氯金酸會被大部分的金屬所還原,還原反應的速度很快,還原後的產物是元素態的金。
氯金酸能夠表現出較強的氧化性。
氯金酸被二甲硫醚還原後會生成二甲硫醚氯化亞金,也常用來生成其他的含金配合物[4]。
氯金酸和氨或銨鹽反應,可以得到灰色且具有強爆炸性的「雷金」,它被認為是Au2O3·3NH3和HNAuCl·NH3的混合物。過量氨和這種混合物反應,產生Au(OH)3·3NH3,用熱水處理得到Au2O3·2NH3。[5]
應用 編輯
膠體金及金的奈米顆粒一般可由檸檬酸鈉還原氯金酸溶液來製備,也可用其他的程序來製備奈米金,例如燙金過程使用的Norrish反應及乙醛還原反應[6]。
參考資料 編輯
- ^ 1.0 1.1 MSDS of Chloroauric Acid
- ^ Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 1057.
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ Marie-Claude Brandys , Michael C. Jennings and Richard J. Puddephatt. Luminescent gold(I) macrocycles with diphosphine and 4,4-bipyridyl ligands. J. Chem. Soc., Dalton Trans. 2000, (24): 4601–4606. doi:10.1039/b005251p.
- ^ 鍾興厚 等. 無機化學叢書 第六卷 鹵素 銅分族 鋅分族. 科學出版社,2012.3. pp 468. 3.6.7 氮化物、疊氮化物、硝酸鹽、磷化物和砷酸鹽
- ^ Facile Photochemical Synthesis of Unprotected Aqueous Gold Nanoparticles Katherine L. McGilvray, Matthew R. Decan, Dashan Wang, and Juan C. Scaiano, J. Am. Chem. Soc.; 2006; 128(50) pp 15980 - 15981; (Communication) doi:10.1021/ja066522h
拓展閱讀 編輯
- Explosive Gold - Explosionandfire (頁面存檔備份,存於網際網路檔案館)(視頻). 氯金酸和氨水反應

