亚硝酸
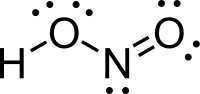
亚硝酸是一种弱的一元酸,化学式为HNO
2,仅在溶液、气相和亚硝酸盐中存在。[1]亚硝酸用于从胺制备重氮盐,所得重氮盐是重氮偶联反应中的试剂,可得到偶氮染料。
| 亚硝酸 | |
|---|---|
| |
| IUPAC名 Nitrous acid | |
| 系统名 Hydroxidooxidonitrogen 羟基氧化氮 | |
| 识别 | |
| CAS号 | 7782-77-6 |
| PubChem | 24529 |
| ChemSpider | 22936 |
| SMILES |
|
| Gmelin | 983 |
| 3DMet | B00022 |
| EINECS | 231-963-7 |
| ChEBI | 25567 |
| KEGG | C00088 |
| MeSH | Nitrous+acid |
| 性质 | |
| 化学式 | HNO2 |
| 摩尔质量 | 47.013 g·mol⁻¹ |
| 外观 | 淡蓝色溶液 |
| 密度 | 约1g/ml |
| pKa | 3.15 |
| 危险性 | |
| NFPA 704 | |
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | 硝酸 |
| 其他阳离子 | 亚硝酸钠 亚硝酸钾 亚硝酸铵 |
| 相关化学品 | 三氧化二氮 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
结构
编辑在气相中,平面亚硝酸分子可以采用顺式和反式两种形式。反式在室温下占主导地位,红外光谱测量表明它更稳定,约2.3kJ/mol左右。[1]
-
反式结构的尺寸
-
反式结构的模型
-
顺式结构
制备
编辑亚硝酸通常通过用无机酸酸化亚硝酸钠水溶液制备。酸化通常在冰水温度下进行:[2][3]
- NaNO2 + H+ = HNO2 + Na+
反应
编辑- 2 HNO2 = NO2 + NO + H2O
- 2 NO2 + H2O = HNO3 + HNO2
在温热或浓缩溶液中,整个反应相当于生成硝酸、水和一氧化氮:
- 3 HNO2 = HNO3 + 2 NO + H2O
有机化学
编辑亚硝酸能用于制备重氮盐:
- HNO2+ RNH2 + H+ = RN+
2 + 2 H2O
其中R是芳基基团。
这种盐广泛用于有机合成,例如用于桑德迈尔反应和制备偶氮染料,这种色彩鲜艳的化合物是苯胺定性测试的基础。[5]亚硝酸用于销毁有毒和潜在爆炸性的叠氮化钠。对大部分的用途,亚硝酸通常是通过无机酸对亚硝酸钠的作用形成的:[6]
- 2 NaN3 + 2 HNO2 = 3 N2 + 2 NO + 2 NaOH
亚硝酸与酮中的两个α-氢原子反应产生肟,其可进一步氧化成羧酸,或还原成胺。该工艺用于己二酸的商业生产。亚硝酸与脂肪醇快速反应生成亚硝酸酯,它们是有效的血管扩张剂:
- (CH3)2CHCH2CH2OH + HNO2 = (CH3)2CHCH2CH2ONO + H2O
称为亚硝胺的致癌物质通常不是有意通过亚硝酸与仲胺反应产生的:
- HNO2 + R2NH = R2N-NO + H2O
地球大气
编辑亚硝酸参与低层大气(对流层)的臭氧收支。一氧化氮和水的非均相反应产生亚硝酸。当该反应发生在大气气溶胶表面时,产物很容易光解成羟基自由基。[7][8]
参见
编辑参考资料
编辑- ^ 1.0 1.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. p. 462.
- ^ Y. Petit, M. Larchevêque. Ethyl Glycidate from (S)-Serine: Ethyl (R)-(+)-2,3-Epoxypropanoate. Org. Synth. 1998, 75: 37. doi:10.15227/orgsyn.075.0037.
- ^ Adam P. Smith, Scott A. Savage, J. Christopher Love, Cassandra L. Fraser. Synthesis of 4-, 5-, and 6-methyl-2,2'-bipyridine by a Negishi Cross-coupling Strategy: 5-methyl-2,2'-bipyridine. Org. Synth. 2002, 78: 51. doi:10.15227/orgsyn.078.0051.
- ^ Kameoka, Yohji; Pigford, Robert. Absorption of Nitrogen Dioxide into Water, Sulfuric Acid, Sodium Hydroxide, and Alkaline Sodium Sulfite Aqueous. Ind. Eng. Chem. Fundamen. February 1977, 16 (1): 163–169. doi:10.1021/i160061a031.
- ^ Clarke, H. T.; Kirner, W. R. "Methyl Red" Organic Syntheses, Collected Volume 1, p.374 (1941). Archived copy (PDF). [2007-07-26]. (原始内容 (PDF)存档于2007-09-30).
- ^ Prudent practices in the laboratory: handling and disposal of chemicals. Washington, D.C.: National Academy Press. 1995 [2022-09-29]. ISBN 978-0-309-05229-0. doi:10.17226/4911. (原始内容存档于2015-03-25).
- ^ Spataro, F; Ianniello, A. Sources of atmospheric nitrous acid: state of the science, current research needs, and future prospects. Journal of the Air & Waste Management Association. November 2014, 64 (11): 1232–1250. PMID 25509545. doi:10.1080/10962247.2014.952846 .
- ^ Anglada, Josef M.; Solé, Albert. The Atmospheric Oxidation of HONO by OH, Cl, and ClO Radicals. The Journal of Physical Chemistry A. November 2017, 121 (51): 9698–9707. Bibcode:2017JPCA..121.9698A. PMID 29182863. doi:10.1021/acs.jpca.7b10715.
