硝酸
此條目需要補充更多來源。 (2017年11月5日) |
硝酸(英語:Nitric acid )為強酸,化學式HNO₃,水溶液俗稱硝鏹水。硝酸是重要的化工原料。純硝酸為無色液體,沸點83℃,味苦,在−42℃時凝結為無色晶體,與水混溶,有強氧化性和腐蝕性。其不同濃度水溶液性質有別,市售濃硝酸為共沸物,溶質質量分數為69.2%,一大氣壓沸點為121.6℃,密度1.42g·cm−3,約16mol·L−1,溶質重量百分比夠大(市售濃度最高為98%以上)的叫發煙硝酸。
| 硝酸 | |||
|---|---|---|---|

| |||

| |||
| |||
| IUPAC名 Nitric acid | |||
| 別名 | 硝鏹水 | ||
| 識別 | |||
| CAS號 | 7697-37-2 | ||
| PubChem | 944 | ||
| ChemSpider | 919 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | GRYLNZFGIOXLOG-UHFFFAOYAO | ||
| Gmelin | 1576 | ||
| 3DMet | B00068 | ||
| UN編號 | 2031 | ||
| EINECS | 231-714-2 | ||
| ChEBI | 48107 | ||
| RTECS | QU5775000 | ||
| KEGG | D02313 | ||
| MeSH | Nitric+acid | ||
| 性質 | |||
| 化學式 | HNO3 | ||
| 莫耳質量 | 63.012 g·mol⁻¹ | ||
| 外觀 | 無色清澈液體 | ||
| 密度 | 1.51 g/cm³ | ||
| 熔點 | -42 °C(231 K) | ||
| 沸點 | 83 °C(356 K)(純酸) (68%aq沸點120.5℃) | ||
| 溶解性(水) | 完全混溶 | ||
| 偶極矩 | 2.17±0.02D | ||
| 危險性 | |||
| 歐盟危險性符號 | |||
| H-術語 | H272, H300, H310, H330, H373, H411 | ||
| P-術語 | P210, P220, P260, P305+351+338, P310, P370+378 | ||
| NFPA 704 | |||
| 閃點 | 不可燃 | ||
| 相關物質 | |||
| 相關化學品 | 亞硝酸 五氧化二氮 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
歷史
編輯硝酸和硫酸一樣由公元8世紀阿拉伯鍊金術士阿布·穆薩·賈比爾·伊本·哈揚(Jabir ibn Hayyan)在乾餾綠礬和硝石混合物時發現,也是化學肥料。[1]硝酸在硝石中發現,故叫硝酸不叫氮酸。
自然存在
編輯雷雨時能生成少量硝酸。打雷放出的能量讓空氣中的N2和O2高溫反應,生成NO:
NO2和水反應生成硝酸:
- 無氧時:
- 含氧時:
實驗室中,用火焰可以產生少量硝酸,如用高壓電與火花隙進行弧光放電效率更高,在工業中曾經用於伯克蘭-艾德法。但因效率低,電能消耗大而不再使用。
結構
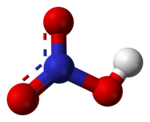
編輯硝酸是平面分子,中心的氮原子為sp2雜化。羥基的氫原子與另外一粒氧原子形成氫鍵,分子呈平面結構,而且氮的三根鍵長都不相同。氮原子垂直於分子平面的一條p軌道是滿的,它與未連接氫的兩粒氧原子上的p軌道共軛,形成 大Π鍵。分子內氫鍵也是硝酸沸點較低的原因。
硝酸是含氧酸,去掉一粒氫原子的結構是硝酸根,一般帶一粒負電荷(硝酸根離子)。硝酸根有對稱的平面等邊三角形結構,4粒原子形成大 鍵,多出來的1粒電子在離域Π鍵裡。[來源請求]
物理性質
編輯純硝酸為無色、易揮發液體,沸點約83℃,凝固點約−42℃,密度為1.51g/ml。可以與水互溶。硝酸是二氧化氮溶於水生成,但二氧化氮溶於水並不會完全水解成硝酸,會有少量二氧化氮分子留存,因此硝酸水溶液呈淡黃色,也會揮發出棕紅色的NO2。一般的濃硝酸指的是16mol/L的HNO3水溶液,密度為1.42g/ml。
-
發煙硝酸
-
70%硝酸
化學性質
編輯純硝酸可以自偶電離:2HNO₃ ⇌ H₂O+NO₂⁺+NO₃⁻
硝酸作為氮的最高價(+5)水化物,其酸性很強,一般情況認為硝酸在水溶液中完全電離。硝酸可以與醇酯化反應,如製備硝酸甘油。(實際會用濃硫酸生成大量NO₂⁺),成本較低且較易處理,與其他更強的脫水劑,例如P₄O₁₀,也可以生成大量硝醯陽離子,這是硝化反應的本質。
- HNO₃+H₂O → H₃O⁺+NO₃⁻(水中)
- HO-NO₂+2H₂SO₄ → NO₂⁺+2HSO₄⁻+H₃O⁺(濃硫酸中)
硝酸的水溶液無論濃稀均有強氧化力及腐蝕力,溶液越濃其氧化力越強。硝酸經光照分解成水、NO2和O2,方程式如下:
- 4HNO₃ → 4NO₂+O₂+2H₂O
一定要盛放在棕色瓶中,並置於陰涼處保存。硝酸能溶解多種金屬(例如銀),生成鹽、水、氮氧化物。隨著溶液變稀,其還原產物逐漸由高價向低價過渡,從最濃到最稀可生成NO₂、NO、N₂O、N₂、NH₄NO₃、H₂。還原產物一般是混合物,金屬與濃硝酸反應多生成NO2,與稀硝酸反應生成如NO等較低價化合物。
鐵、鋁、鉻等金屬遇冷的濃硝酸可以鈍化,只在表面形成緻密的氧化膜,不會繼續反應。
濃硝酸和濃鹽酸的物質量按1比3混合,即為王水,能溶解金、鉑等穩定金屬。
硝酸鹽大多易遇熱分解,生成氧氣、氮氧化物、金屬氧化物(中途也可能生成亞硝酸鹽等)。
硝酸銨中的硝酸根與銨根,平均能量大於有其平均價數之一氧化二氮,在固態時均化反應(動力學所限,在溶液內不反應)(即加熱或撞擊分解生成一氧化二氮和水),一般使用現代合成炸藥引爆,威力與TNT相去不遠,但成本極低,因此用於國防工業及工程而獲美譽「國防工業之母」(主要製造硝基含能化合物(現代合成炸藥)。硝酸鉀就是黑火藥的成分之一)。
HNO₃+NaOH → NaNO₃+H₂O
製備
編輯歷史上,曾使用伯克蘭-艾德法,但因能耗大、效率低,後被取代。
現代工業用二氧化氮與水混合製備硝酸:奧士華法。其原料二氧化氮是由氨氧化而得,硝酸工業與製氨工業密不可分。
(ΔH=−114kJ/mol)
(ΔH=−117kJ/mol)
反覆把生成的氣體通入水中即可得到甚純的硝酸,不過工業一般用稀硝酸吸收二氧化氮。這樣製得的硝酸濃度通常為68%。
製備純硝酸
編輯NaNO₃+H₂SO₄ → NaHSO₄+HNO₃
其二步反應是硫酸氫鹽與硝酸鹽反應,值得注意的是,反應溫度更高,硝酸會分解,影響產率。
人體影響
編輯硝酸不論濃稀溶液都有氧化力和腐蝕力,對人很危險,僅濺到皮膚上也會引起嚴重燒傷。皮膚接觸硝酸後會慢慢變黃,最後變黃的表皮會起皮脫落(硝酸和蛋白質接觸後,會引起黃蛋白反應而變性)。此外,濃硝酸需以深色玻璃瓶盛裝,避免受到光照反應釋出有毒NO2。
與金屬反應
編輯- 2HCl(水)+Zn(固) → ZnCl₂(水)+H₂(氣)
硝酸根(NO₃⁻)的氧化力比氫離子(H⁺)強,硝酸與金屬反應不會生成氫氣。
濃硝酸(約16mol/L)與金屬反應,主要生成紅棕色的二氧化氮氣體:
- Zn(固)+4HNO₃(水) → Zn(NO₃)₂(水)+2NO₂(氣)+2H₂O(液)
稀硝酸(約6mol/L)與金屬反應,主要生成一氧化氮氣體:
- 3Zn(固)+8HNO₃(水) → 3Zn(NO₃)₂(水)+2NO(氣)+4H₂O(液)
更稀的硝酸(約2mol/L以下)與金屬反應,產物從一氧化二氮到氮氣到銨根離子不等。
普遍認為,硝酸與金屬反應時,各還原產物(NO₂、NO、N₂O、N₂、NH₃)都可以生成。但硝酸、水、氮氧化物、亞硝酸、連二次硝酸等物質間的多對平衡,不同濃度硝酸的還原產物有很大差異。
極稀硝酸和活潑金屬生成氫氣的說法沒有得到證實。[來源請求]
工業用途
編輯硝酸在工業和實驗室都是很常用的酸。
作為硝酸鹽和硝酸酯的必需原料,硝酸用來製取硝酸銨、硝酸鉀等一系列硝酸鹽類氮肥;也用來製取三硝基甲苯(TNT)、硝化甘油等硝酸酯類或含硝基的炸藥。
參見
編輯注釋
編輯- ^ Nitric Acid. [2020-09-15]. (原始內容存檔於2010-01-29).
- ^ P. W. Atkins, Molecules, 1987, ISBN 0-7167-5019-8